Peróxido
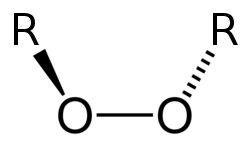
Os peróxidos son substancias que presentan un enlace osíxeno-osíxeno e que conteñen o osíxeno en estado de oxidación −1.[1][2] A fórmula xeral dos peróxidos é Metal + (O−1)2−2. Xeralmente compórtanse como substancias oxidantes.[3]
En contacto cun material combustible poden provocar incendios ou mesmo explosións. Con todo, fronte a oxidantes fortes como o permanganato, poden actuar como redutor oxidándose a osíxeno elemental. É importante puntualizar que o peróxido ten carga.
En poucas palabras, son óxidos que presentan maior cantidade de osíxeno que un óxido normal e na súa estrutura manifestan un enlace covalente sinxelo apolar entre osíxeno e osíxeno.
Síntese
[editar | editar a fonte]O peróxido máis coñecido e principal composto de partida na síntese doutros peróxidos é o peróxido de hidróxeno (H2O2). Hoxe en día adóitase obter por autooxidación de naftohidroquinona. Antigamente utilizábase a formación de peróxido de bario ou a hidrólise de persulfatos que á súa vez se xeraban por electrólise de sulfatos en disolución acuosa con altas densidades de corrente por superficie do eléctrodo.
Moitas substancias orgánicas poden converterse en hidroperóxidos en reaccións de autooxidación en presenza de luz e osíxeno atmosférico. Especialmente perigoso é a formación a partir de éteres xa que estes transfórmanse moi facilmente e os peróxidos adóitanse enriquecer no residuo dunha posterior destilación. Alí poden producir explosións moi fortes. Moitos dos accidentes máis tráxicos de laboratorio débense a este tipo de reacción. Por tanto antes de destilar cantidades maiores destes disolventes hai que probar a presenza de peróxidos con papel impregnado de ioduro de potasio e amidón. A formación dunha cor azulado ou escuro indica a presenza de peróxido (o peróxido oxida o ioduro a iodo elemental que, á súa vez, forma co amidón un complexo de inclusión de cor característica escura).
Usos
[editar | editar a fonte]Parámetro de análise na industria alimentaria
[editar | editar a fonte]Na industria alimentaria utilízase como parámetro para medir a calidade dos aceites e as graxas, os cales son susceptibles de enranciarse ou descomporse, mediante a técnica de medición do índice de peróxido (ou índice de peroxidación); sendo a peroxidación unha das causas que provoca características rechazables na calidade dos alimentos (tales como aceites, entre outros).
Aplicacións químicas
[editar | editar a fonte]Igualmente as aplicacións dos peróxidos son moi versátiles (pasan da barbaría onde se empregan en tinguiduras para aclarar o pelo até en combustibles de foguetes.)
Na industria química utilízanse na obtención dos epóxidos, en diversas reaccións de oxidación, como iniciadores de reaccións radicalarias por exemplo para endurecer poliésteres ou na fabricación do glicerol a partir do alcol hidroxipropénico. O ácido peroxi-trifluoroacético (F3C–C(=O)–O–O–H) é un desinfectante moi potente e emprégase como tal na industria farmacéutica. En odontoloxía utilízase para o blanqueamiento dos dentes, xa sexa aplicado en xel ou en bandas impregnadas de peróxido en concentracións de 9%, 16% e 25%.
Estado de oxidación
[editar | editar a fonte]O estado de oxidación do osíxeno nos grupos peróxido é -1
Analítica
[editar | editar a fonte]Os peróxidos dan unha coloración alaranxada con disolucións de óxido de titanio en ácido sulfúrico concentrado.
Con dicromato de potasio forman o peróxido de cromo (VI) de cor azul que pode ser extraído con éter etílico.
Notas
[editar | editar a fonte]- ↑ IUPAC, Compendium of Chemical Terminology (2006). "Peroxides" (en inglés). Consultado o 28 de setembro de 2015.
- ↑ IUPAC, Compendium of Chemical Terminology (2006). "Oxidation state" (en inglés). Consultado o 28 de setembro de 2015.
- ↑ "Peróxido de hidrógeno" (PDF) (en español). ATSDR. abril de 2002. Consultado o 23 de maio de 2015.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
