Metionina
| Metionina | |
|---|---|
 | |
 | |
Metionina | |
Outros nomes Ácido 2-amino-4-(metiltio)butanoico | |
| Identificadores | |
| Abreviaturas | Met, M |
| Número CAS | 59-51-8, 63-68-3 (isómero L), 348-67-4 (isómero D) |
| PubChem | 876 |
| ChemSpider | 853, 5907 (isómero L) |
| UNII | 73JWT2K6T3 |
| Número CE | 200-432-1 |
| KEGG | D04983 |
| ChEBI | CHEBI:16811 |
| ChEMBL | CHEMBL42336 |
| Código ATC | V03,ATCvet A05 BA90, ATCvet G04 BA90 |
| Imaxes 3D Jmol | Image 1 Image 2 |
| |
| |
| Propiedades[2] | |
| Fórmula molecular | C5H11NO2S |
| Masa molar | 149,21 g mol−1 |
| Aspecto | Po cristalino branco |
| Densidade | 1,340 g/cm3 |
| Punto de fusión | 281 °C descomp. |
| Solubilidade en auga | Soluble |
| Acidez (pKa) | 2.28 (carboxilo), 9,21 (amino)[1] |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |



A metionina (abreviada como Met ou M) é un α-aminoácido coa fórmula química HO2CCH(NH2)CH2CH2SCH3, que forma parte das proteínas, polo que é un aminoácido proteinoxénico. É un aminoácido esencial cunha cadea lateral neutra non polar e con xofre. O seu punto isoeléctrico é 5,74.
Función
[editar | editar a fonte]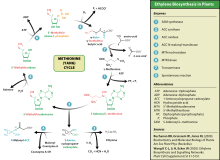
Xunto coa cisteína, a metionina é un dos aminoácidos proteicos que conteñen xofre. O seu derivado, a S-adenosilmetionina (SAM), serve como doante metilos. A metionina é un intermediario na biosíntese da cisteína, a carnitina, a taurina, a lecitina, a fosfatidilcolina e outros fosfolípidos. Unha conversión defectuosa da metionina pode causar ateroesclerose.
Este aminoácido úsano as plantas para a síntese de etileno. Este proceso coñécese como ciclo de Yang ou o ciclo da metionina.
A metionina está codificada por un só codón do código xenético, o AUG. Como este codón funciona tamén como codón de iniciación, todas as proteínas eucariotas e de arqueas empezan a traducirse empezando por metionina, aínda que modificacións postraducionais poden eliminala despois. Nas bacterias as proteínas empezan por N-formilmetionina.
Biosíntese
[editar | editar a fonte]A metionina é un aminoácido esencial, polo que non pode ser sintetizado polos humanos, e debe inxerirse na dieta. Nas plantas e microorganismos, a metionina sintetízase por unha vía que utiliza tanto ácido aspártico coma cisteína. Primeiro, o ácido aspártico convértese, vía β-aspartil-semialdehido, en homoserina, introducindo un par de grupos metilenos contiguos. A homoserina convértese en 0-succinilhomoserina, a cal reacciona coa cisteína para producir cistationina, que é escindida para dar paso á homocisteína. A posterior metilación do grupo tiol por folatos orixina a metionina. Tanto a cistationina-γ-sintetase coma a cistationina-β-sintetase requiren piridoxil-5’-fosfato como cofactor, mentres que a homocisteína metiltransferase require vitamina B12 como cofactor.
Os encimas que participan na biosíntese da metionina son:
- Aspartoquinase
- β-aspartato semialdehido deshidroxenase
- homoserina deshidroxenase
- homoserina acetiltransferase
- cistationina-γ-sintetase
- cistationina-β-liase
- metionina sintetase (en mamíferos, este paso é efectuado pola homocisteína metiltransferase)


Encimas:
- EC 2.1.1.- Metil Transferases SAM dependientes
- EC 2.1.1.5 Betaína-homocisteína S-metiltransferase
- EC 2.1.1.13 Metionina sintase
- EC 2.3.1.30 Serina acetiltransferase
- EC 2.3.1.46 Homoserina O-succiniltransferase
- EC 2.5.1.6 Metionina adenosiltransferase
- EC 2.5.1.47 Cisteína sintase
- EC 2.5.1.48 Cistationina γ-sintase
- EC 3.3.1.1 S-Adenosilhomocisteína hidrolase
- EC 4.1.1.57 Metionina descarboxilase
- EC 4.2.1.22 Cistationina-β-sintase
- EC 4.4.1.1 Cistationina γ -liase
- EC 4.4.1.8 Cistationina-β-liase
Sínteses
[editar | editar a fonte]A metionina racémica pode sintetizarse a partir do dietil sodio ftalimidomalonato por alquilación con cloroetilmetilsulfuro (ClCH2CH2SCH3) seguido de hidrólise e descarboxilación.
Degradación
[editar | editar a fonte]Na súa degradación oxidativa a metionina orixina succinil-CoA, polo que é un aminoácido glicoxénico.
Outras vías bioquímicas
[editar | editar a fonte]Aínda que os mamíferos non poden sintetizar metionina, esta pode utilizarse en diversas vías bioquímicas:
Xeración de homocisteína
[editar | editar a fonte]A metionina convértese en S-adenosilmetionina (SAM) por acción da metionina adenosiltransferase.
A S-adenosilmetionina serve como doante de metilos en moitas reaccións de metiltransferase e convértese en S-adenosilhomocisteína (SAH).
A Adenosilhomocisteinase converte a S-adenosilhomocisteína en homocisteína.
A homocisteína pode ter dous destinos: pode usarse para rexenerar a metionina, ou para formar cisteína.
Rexeneración da metionina
[editar | editar a fonte]A metionina pode rexenerarse a partir da homocisteína por acción da metionina sintase.
A homocisteína pode tamén remetilarse usando glicina betaína (NNN-trimetil glicina, TMG) a metionina pola acción do encima betaína-homocisteína metiltransferase (E.C.2.1.1.5, BHMT). Este encima supón o 1,5% de todas as proteínas solubles do fígado, e probas recentes suxiren que pode ter unha influencia maior ca a metionina sintase sobre a homeostase da metionina e homocisteína.
Conversión a cisteína
[editar | editar a fonte]A homocisteína pode converterse en cisteína.
- Cistationina-β-sintase (un encima PLP-dependente) combina a homocisteína e a serina para producir cistationina. Esta, en lugar de degradarse vía cistationina-β-liase, como na vía biosintética, escíndese en cisteína e α-cetobutirato por medio da cistationina-γ-liase.
- O encima α-cetoácido deshidroxenase converte o α-cetobutirato en propionil-CoA, o cal se metaboliza a succinil-CoA nun proceso en tres pasos.
Biosíntese de poliaminas
[editar | editar a fonte]As poliaminas espermina e espermidina requiren a transferencia dun sustituínte 3-aminopropil ao nitróxeno dunha molécula de putrescina ou de espermina. Dito grupo obtense por descarboxilación da S-adenosilmetionina (SAM). Cando se sintetiza a espermina ou a espermidina, o S-metiltiorribósido sofre unha serie de transformacións de tal maneira que se recupere a metionina. Dita vía coñécese como Vía de salvamento da metionina ("Methionine Salvage Pathway")[3]

Encimas:
- EC 1.13.11.54 Acirreductona dioxixenase dependente de ferro (II).
- EC 1.13.11.53 Acirreductona dioxixenase dependente de níquel (II)
- EC 2.5.1.22 Espermina sintase
- EC 2.6.1.5 Tirosina transaminase (tamén pode transaminar metionina)[4]
- EC 2.7.1.100 S-Metil-5-tiorribosa quinase
- EC 3.1.3.77 Acirredutona sintase
- EC 3.2.2.16 Metiltioadenosina nucleosidase
- EC 4.1.1.50 S-Adenosilmetionina descarboxilase
- EC 4.2.1.109 Metiltiorribulosa 1-fosfato deshidratase
- EC 5.3.1.23 S-metil-5-tiorribosa-1-fosfato isomerase
Outras biosínteses
[editar | editar a fonte]A metionina está implicada na biosíntese de etileno,[5] a nicotianamina,[6] as salinosporamidas[7] e varios glicosinolatos[8] tales como a sinigrina, a glicoqueirolina, a glicoerucina, a glicoiberina, a glicoiberverina, a glicorrafanina e o sulforrafano[9]
Aspectos dietéticos
[editar | editar a fonte]Podemos atopar niveis bastante altos de metionina nas sementes de sésamo, noces do Brasil, peixe , carne e outras sementes. Existen numerosas froitas e vexetais que apenas conteñen metionina. A maioría dos legumes, ten unha cantidade moi baixa de metionina. É costume frecuente en moitas partes do mundo a combinación de alimentos que complementan a súa composición en aminoácidos, como cereais (con metionina) e legumes (con lisina).
A metionina racémica adoita engadirse como ingrediente á comida para mascotas.
Notas
[editar | editar a fonte]- ↑ Dawson, R.M.C.; et al. (1959). Data for Biochemical Research. Oxford: Clarendon Press.
- ↑ Modelo:RubberBible62nd.
- ↑ Jonathan W. Wray, Robert H. Abeles (1995). "The Methionine Salvage Pathway in Klebsiella pneumoniae and Rat Liver IDENTIFICATION AND CHARACTERIZATION OF TWO NOVEL DIOXYGENASES". The Journal of Biological Chemistry, 270: 3147–3153. doi:10.1074/jbc.270.7.3147.
- ↑ Heilbronn J, Wilson J, Berger BJ. (1999). "Tyrosine aminotransferase catalyzes the final step of methionine recycling in Klebsiella pneumoniae.". J Bacteriol. 181 (6): 1739–47.
- ↑ http://www.enzyme-database.org/reaction/misc/ethene.html
- ↑ http://www.enzyme-database.org/reaction/misc/nicotian.html
- ↑ Yolande A. Chan,Angela M. Podevels,Brian M. Kevanya, Michael G. Thomas (2009). "Biosynthesis of polyketide synthase extender units". Natural Product Reports 26: 103. doi:10.1039/b801658p.
- ↑ http://www.plantphysiol.org/cgi/reprint/86/2/319.pdf
- ↑ Paul M. Dewick (2009). Medicinal natural products: a biosynthetic approach. John Wiley and Sons. ISBN 9780470741689.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]- Cisteína
- Ciclo da metionina
- N-formilmetionina
Ligazóns externas
[editar | editar a fonte]- Methionine (en inglés)
- Metionina (en castelán)
- Health Library Arquivado 03 de marzo de 2007 en Wayback Machine. (en inglés)
Os 20 aminoácidos máis comúns | |
|---|---|
| Aminoácidos esenciais para os humanos | Fenilalanina · Isoleucina · Leucina · Lisina · Metionina · Treonina · Triptofano · Valina · Histidina |
| Outros | Ácido aspártico · Ácido glutámico · Alanina · Arxinina · Asparaxina · Cisteína · Glutamina · Glicina · Prolina · Serina · Tirosina |
Principais familias bioquímicas Alcaloides · Aminoácidos · Carbohidratos · Carotenoides · Cofactores enzimáticos · Esteroides · Flavonoides · Glicósidos · Lípidos · Péptidos · Policétidos · Tatrapirrois · Terpenos | |
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
