Dipéptido
Un dipéptido é un composto orgánico orixinado pola unión de dous aminoácidos. Os aminoácidos que o forman poden ser o mesmo ou distintos. Cando son diferentes, son posibles dous isómeros do dipéptido, dependendo da secuencia. Varios dipéptidos son fisioloxicamente importantes e algúns son importantes para o sistema nervioso e comercialmente. Un dipéptido ben coñecido é o aspartamo, un edulcorante artificial.[1]
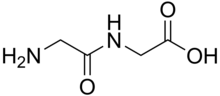
Os dipéptidos son sólidos brancos. Moitos son moito máis hidrosolubles que os seus aminoácidos parantais.[1] Por exemplo, o dipéptido Ala-Gln ten unha solubilidade de 586 g/L, o que é máis de dez veces a solubilidade da Gln (35 g/L). Os dipéptidos mostran diferentes estabilidades, por exemplo ante a hidrólise. A Gln non resiste procedementos de esterilización, mentres que o dipéptido mencionado si. Como os dipéptidos tenden a hidrolizarse, a súa alta solubilidade aprovéitase en infusións, é dicir, para proporcionar nutición.[2]
Exemplos
[editar | editar a fonte]
Valor comercial
[editar | editar a fonte]Uns seis dipéptidos son de interese comercial.[1]
- Aspartamo (N-L-α-aspartil-L-fenilalanina 1-metil éster) é un edulcorante artificial.
- Carnosina (beta-alanil-L-histidina) e anserina (beta-alanil-N-metil histidina) están altamente concentrados nos tecidos muscular e cerebral. Utilízanse en medicinas deportivas.
- Acetilcarnosina, prevención das cataratas.
- Ala-Gln e Gly-Tyr, infusións.[2]
- Val-Tyr, antihipertensivo.
Outros dipéptidos
[editar | editar a fonte]- Homoanserina (N-(4-aminobutiril)-L-histidina), é outro dipéptido identificado no cerebro e músculo de mamíferos.
- Kyotorfina (L-tirosil-L-arxinina), é un dipéptido neuroactivo que xoga un papel na regulación do cerebro.
- Balenina (ou ofidina) (beta-alanil-N tau-metil histidina), foi identificado nos músculos de varias especies de mamíferos (incluídos os humanos) e no polo.
- Glorina (N-propionil-γ-L-glutamil-L-ornitina-δ-lac etil éster), é un dipéptido quimiotáctic do mofo mucoso Polysphondylium violaceum.
- Barettina (ciclo-[(6-bromo-8-en-triptofan)-arxinina]), é un dipéptido cíclico da esponxa mariña Geodia barretti.
- Pseudoprolina.
- Dialanina, é usada comunmente como modelo en dinámica molecular.
Produción
[editar | editar a fonte]Dipéptidos sintéticos
[editar | editar a fonte]Os dipéptidos prodúcense por acoplamento de aminoácidos. O grupo amino dun aminoácido convértese en non nucleofilico (P en eq) e o grupo ácido carboxílico (carboxilo) do segundo aminoácido é desactivado ao seu metil éster. Os dous aminoácidos modificados combínanse despois en presenza dun axente acoplante, que facilita a formación do enlace amida:
- RCH(NHP)CO2H + R'CH(NH2)CO2CH3 → RCH(NHP)C(O)NH(CHR')CO2CH3 + H2O
Despois desta reacción de acoplamento, o grupo P protector amino e o éster son convertidos nos grupos amino e carboxilo libres dos extremos do dipéptido, respectivamente.[3]
Para moitos aminoácidos, os grupos funcionais fillos son protexidos. A condensación do amino e do carboxilo para formar o enlace peptídico xeralmente emprega axentes de acoplamento para activar o grupo carboxilo.[4]
A síntese do péptido azlactona de Bergmann é unha síntese orgánica clásica para a preparación de dipéptidos.[1]
Biosíntese
[editar | editar a fonte]Os dipéptidos prodúcense a partir de polipéptidos pola acción da hidrolase dipeptidil peptidase.[5] As proteínas da dieta son dixeridas a dipéptidos e aminoácidos, e os dipéptidos son absorbidos máis rapidamente que os propios aminoácidos porque se captan por medio dun mecanismo diferente. Os dipéptidos activan as células G do estómago para que segreguen a hormona gastrina.
Dicetopiperazinas (dipéptidos cíclicos)
[editar | editar a fonte]
As dicetopiperazinas son unha clase especial de dipéptidos, que son cíclicos. Fórmanse como produtos colaterais na sísntese de péptidos. Moitos foron producidos a partir de aminoácidos non canónicos.[7]
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 1,2 1,3 Yagasaki, Makoto; Hashimoto, Shin-ichi (2008). "Synthesis and application of dipeptides; current status and perspectives". From Applied Microbiology and Biotechnology 81 (1): 13–22. PMID 18795289. doi:10.1007/s00253-008-1590-3.
- ↑ 2,0 2,1 Furst, Peter; Pogan, Karin; Stehle, Peter (1997). "Glutamine dipeptides in clinical nutrition". Nutrition 13 (7–8): 731–7. PMID 9263278. doi:10.1016/S0899-9007(97)83035-3.
- ↑ Subirós-Funosas, Ayman El-Faham, Fernando Albericio (2013). "Low-epimerization Peptide Bond Formation with Oxyma Pure: Preparation of Z-L-Phg-Val-OMe". Org. Synth. 90: 306. doi:10.15227/orgsyn.090.0306.
- ↑ Jean-Simon Suppo, Renata Marcia de Figueiredo, Jean-Marc Campagne (2015). "Dipeptide Syntheses via Activated α-Aminoesters". Org. Synth. 92: 296–308. doi:10.15227/orgsyn.092.0296.
- ↑ Steane, Richard. "Hydrolysis of a dipeptide". BioTopics. Consultado o 28 July 2014.
- ↑ Borthwick AD, Liddle J (January 2013). "Retosiban and Epelsiban: Potent and Selective Orally available Oxytocin Antagonists". En Domling A. Methods and Principles in Medicinal Chemistry: Protein-Protein Interactions in Drug Discovery. Weinheim: Wiley-VCH. pp. 225–256. ISBN 978-3-527-33107-9.
- ↑ Borthwick, A. D. (2012). "2,5-Diketopiperazines: Synthesis, Reactions, Medicinal Chemistry, and Bioactive Natural Products". Chem. Rev. 112 (7): 3641–716. PMID 22575049. doi:10.1021/cr200398y.
Véxase tamén
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- An introduction to dipeptides en PeptideGuide.
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
