Thioacétal
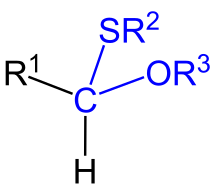
Un thioacétal est l'analogue soufré d'un acétal : l'un des deux atomes d'oxygène de l'acétal est substitué par un atome de soufre[1]. Il est obtenu d'une manière similaire à un acétal par réaction d'un thiol et d'un aldéhyde :
Les dithioacétals sont eux aussi des équivalents soufrés de l'acétal, mais dans leur cas, les deux atomes d'oxygène ont été substitués par des atomes de soufre. Ils sont préparés de manière similaire :
Ces réactions sont généralement catalysées par un acide de Lewis ou un acide de Brønsted.
-
Formule générale d'un thioacétal.
-
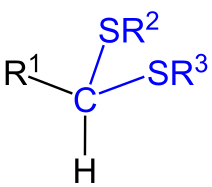
Formule générale d'un dithioacétal.
Dans la représentation ci-dessus, on parle de dithioacétals symétriques lorsque R2 = R3, et de dithioacétals asymétriques dans le cas contraire.
Les dithioacétals obtenus à partir d'un aldéhyde et d'éthane-1,2-dithiol (en) HSCH2CH2SH ou de propane-1,3-dithiol (en) HSCH2CH2CH2SH sont particulièrement utiles en synthèse organique[2] :
En effet, contrairement à l'atome de carbone portant la fonction aldéhyde qui est électrophile, le carbone fonctionnel des dérivés déprotonés des dithioacétals est nucléophile.
- R′CHS2C2H4 + R2NLi ⟶ R′CLiS2C2H4 + R2NH.
L'inversion de polarité entre R′(H)Cδ+Oδ– et R′CLi(SR)2 est appelée umpolung. On réalise couramment cette réaction avec un 1,3-dithiane. L'intermédiaire lithié peut être utilisé pour diverses réactions nucléophiles formant des liaisons chimiques avec hydrolyse du dithiocétal en carbonyle. Dans ce processus, appelé réaction de Corey-Seebach (en), les dithioacétals servent d'intermédiaires dans la synthèse de cétones asymétriques à partir d'aldéhydes.
Voir aussi
[modifier | modifier le code]Notes et références
[modifier | modifier le code]- (en) « thioacetals », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8)
- (en) P. Stütz et P. A. Stadler, « 3‐Alkylated and 3‐Acylated Indoles from a Common Precursor: 3‐Benzylindole and 3‐Benzoylindole », Organic Syntheses, vol. 56, , p. 8 (DOI 10.15227/orgsyn.056.0008, lire en ligne)
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.