Dithionite
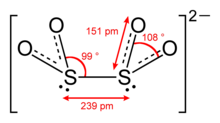

L'anion dithionite (DT) est un oxyanion de soufre de formule S2O42−[1] dérivant de l'hypothétique acide dithioneux H2S2O4.
Propriétés chimiques
[modifier | modifier le code]L'acide dithioneux n'a jamais été isolé à l'état pur ni même détecté en solution. L'ion dithionite peut subir aussi bien une hydrolyse acide en thiosulfate S2O32− et bisulfite HSO3− qu'une hydrolyse basique en sulfite SO32− et sulfure S2− :
Applications
[modifier | modifier le code]Le dithionite de sodium est très utilisé dans l'industrie comme réducteur. Il est souvent utilisé avec des chélateurs tels que l'acide citrique pour réduire l'oxyhydroxyde de fer(III) FeO(OH) en composés de fer(II) solubles et pour éliminer les phases minérales amorphes de fer(III) dans les analyses de sols (extraction sélective).
La décomposition des dithionites libère des espèces chimiques réductrices à base de soufre qui peuvent être très corrosives pour l'acier et l'acier inoxydable. L'ion thiosulfate S2O32− est ainsi bien connu pour favoriser les piqûres de rouille (corrosion localisée) tandis que les sulfures S2− dissous (tels que Na2S) favorisent la corrosion sous contrainte.
Notes et références
[modifier | modifier le code]- (en) Union internationale de chimie pure et appliquée, Nomenclature of Inorganic Chemistry : IUPAC Recommendations 2005, Cambridge, RSC–IUPAC, , 366 p. (ISBN 0-85404-438-8, lire en ligne [PDF]), p. 130.
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
