Kompleksi (kemia)
Wikipediasta

Kompleksiyhdisteillä (myös koordinaatiokompleksi) tarkoitetaan molekyylejä, jotka ovat muodostuneita keskusatomista tai -ionista ja sitä ympäröivistä ioneista, molekyyleistä tai atomeista.
Tyypillisessä kompleksiyhdisteen rakenteessa keskusatomina toimii positiivisesti varautunut siirtymämetalleihin kuuluva metalli-ioni, johon on liittynyt koordinaatiosidoksella ligandeja. Riippuen keskusatomin koosta ja varauksesta ligandeja saattaa olla 1–12.
Kompleksiyhdisteen nimeäminen
[muokkaa | muokkaa wikitekstiä]Kompleksiyhdisteen nimessä ilmoitetaan ensin ligandit niiden aakkosjärjestyksen mukaisessa järjestyksessä. Ligandin määrä ilmoitetaan etuliitteellä di-, tri-, tetra- ja niin edelleen. Jos ligandina on moniatominen ryhmä, liitteenä käytetään liitteitä bis-, tris-, tetrakis- ja niin edelleen. Tämän jälkeen ilmoitetaan keskusatomi ja suluissa keskusatomin hapetusluku. Jos kompleksi on anioni saa keskusatomin nimi -aatti-päätteen. Joissain tapauksissa pääte lisätään alkuaineen latinankieliseen nimeen; esimerkiksi kullan tapauksessa yhdiste on auraatti ja hopean tapauksessa argentaatti.
Ligandien nimiä
[muokkaa | muokkaa wikitekstiä]| Anioninen ligandi | Nimi | Neutraali ligandi | Nimi |
| Cl- | Kloro | H2O | Akva |
| Br- | Bromo | NH3 | Ammiini |
| OH- | Hydrokso | NO+ | Nitrosyyli |
| CN- | Syano | CO | Karbonyyli |
| N3- | Nitrido | H2NCH2CH2NH2 | Etyleenidiamiini |
| N3- | Atsido | ||
| NO2- | Nitro | ||
| NO3- | Nitraatto | ||
| SO32- | Sulfiitto | ||
| SO42- | Sulfaatto | ||
| S2O32- | Tiosulfaatto | ||
| OCN- | Syanaatto | ||
| NCO- | Isosyanaatto | ||
| SCN- | Tiosyanaatto | ||
| NCS- | Isotiosyanaatto | ||
| CH3COO- | Asetaatto | ||
| (COO)22- | Oksalaatto |
Isomeria
[muokkaa | muokkaa wikitekstiä]Kompleksiyhdisteillä on usein monta erilaista stereo- ja rakenneisomeeriä. Eri isomeerit voivat erota toisistaan esimerkiksi silmin nähtävän värin perusteella.
Esimerkiksi propellimaiset yhdisteet ilmentävät aksiaalista kiraalisuutta (P,M- eli Δ,Λ-stereoisomeriaa).[1]
cis, trans, fac, mer -stereoisomeria
[muokkaa | muokkaa wikitekstiä]Alla kuvissa esimerkkejä yhdestä stereoisomerian muodosta, cis, trans, fac, mer -stereoisomeriasta, jossa kloori (vihreä) määrää sijaintiensa perusteella oktaedrisen kompleksin etuliitteen. Ryhmiä tässä isomerian muodossa tulee olla kaksi erilaista ja näiden tulee sijoittua kuten kuvissa alla. fac on lyhenne sanasta fasiaalinen (engl. facial) ja mer meridionaalinen (engl. meridional).[1]
-
cis-[CoCl2(NH3)4]+ -
trans-[CoCl2(NH3)4]+ -
fac-[CoCl3(NH3)3] -
mer-[CoCl3(NH3)3]
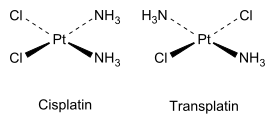
Tasoneliömäisissä yhdisteissä, joissa ryhmiä on kaksi, isomeerit voivat olla cis tai trans kuten alla olevissa kuvissa[1], joissa on esitetty sisplatiini ja transplatiini.
Metallien akvaionit
[muokkaa | muokkaa wikitekstiä]Kompleksiyhdistettä, jossa metalli-ioniin on sitoutunut ligandina yksi tai useampi vesimolekyyli, sanotaan metallin akvaioniksi. Sellaisia esiintyy varsinkin suolojen vesiliuoksissa, mutta monissa aineissa silloinkin, kun ne ovat kiteisessä muodossa, jolloin kyseessä on kidevesi.[2]
Metallien akvaionit ovat heikkoja happoja eli niissä oleva vesiligandi voi liuoksessa luovuttaa protonin. Jos metalli-ionille, jonka varaus on +n ja vesiligandien lukumäärä m, käytetään merkintää Me(H2O)mn+, tapahtuu reaktio seuraavasti:
- [Me(H2O)m]n+ + H2O [MeOH(H2O)m−1](n−1)n+ + H3O+[3]
Tämä reaktio tapahtuu sitä herkemmin, mitä lujemmin metalli-ioni voi sitoa veden hapen elektroneja.[4] Esimerkiksi raudan akvaionin Fe(H2O)63+ happovakio on pKa = 3,1, joten se on heikompi happo kuin fosforihappo, mutta vahvempi kuin esimerkiksi etikkahappo. Toisaalta sinkin akvaionin Zn(H2O)62+ happovakio on pKa = 0,7, joten se on varsin vahva happo.[5]
Katso myös
[muokkaa | muokkaa wikitekstiä]Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ a b c Nomenclature of inorganic chemistry. IUPAC recommendations 2005, s. 180, 182, 191. Cambridge: Royal Society of Chemistry, 2005. ISBN 9780854044382. Teoksen verkkoversio (pdf).
- ↑ Matti Tiilikainen & Ilkka Virtamo: Kemia 1, s. 59. WSOY, 1968.
- ↑ Tiilikainen, Virtamo, s. 105–106
- ↑ Tiilikainen & Virtamo, s. 105–106
- ↑ Antti Kivinen & Osmo Mäkitie: Kemia, s. 195. Otava, 1988. ISBN 951-1-10136-6.
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
![cis-[CoCl2(NH3)4]+](https://upload.wikimedia.org/wikipedia/commons/thumb/b/be/Cis-dichlorotetraamminecobalt%28III%29.png/120px-Cis-dichlorotetraamminecobalt%28III%29.png)
![trans-[CoCl2(NH3)4]+](https://upload.wikimedia.org/wikipedia/commons/thumb/5/56/Trans-dichlorotetraamminecobalt%28III%29.png/120px-Trans-dichlorotetraamminecobalt%28III%29.png)
![fac-[CoCl3(NH3)3]](https://upload.wikimedia.org/wikipedia/commons/thumb/6/69/Fac-trichlorotriamminecobalt%28III%29.png/109px-Fac-trichlorotriamminecobalt%28III%29.png)
![mer-[CoCl3(NH3)3]](https://upload.wikimedia.org/wikipedia/commons/thumb/5/54/Mer-trichlorotriamminecobalt%28III%29.png/120px-Mer-trichlorotriamminecobalt%28III%29.png)