Síntesis de Strecker
La primera síntesis conocida de un aminoácido se realizó en 1850 en el laboratorio de Adolph Strecker en Tubingen, Alemania. Strecker añadió acetaldehído a una solución acuosa de amoníaco y ácido cianhídrico. El producto que se obtuvo fue α-amino propionitrilo, que Strecker hidrolizó a alanina racémica.[1] La síntesis de Strecker es una serie de reacciones químicas que permiten la síntesis de un α-aminoácido partiendo de un aldehído o una cetona.[2][3][4]
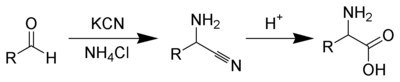
El compuesto carbonílico condensa con cloruro de amonio a una imina, que en presencia de cianuro sufre la adición de este para formar un α-aminonitrilo, el cual es seguidamente hidrolizado para conseguir el aminoácido deseado.
Mediante la síntesis de Strecker se puede obtener una gran variedad de aminoácidos a partir de aldehídos apropiados. Primero, el aldehído reacciona con amoniaco para formar una imina. La imina es un análogo nitrogenado del grupo carbonilo y es electrofílica cuando se protona. El ataque del ion cianuro a la imina protonada da lugar a α-aminonitrilo. El mecanismo es similar al de la formación de una cianohidrina, excepto en que la síntesis de Strecker el ion cianuro ataca a la imina en lugar de al aldehído.[1]
En un paso separado, la hidrólisis del α-aminonitrilo da lugar a un α-aminoácido.[1]
La síntesis de Strecker clásica conduce a α-aminoácidos racémicos; no obstante, en la actualidad existen métodos enantioselectivos.[5][6]
Mecanismo
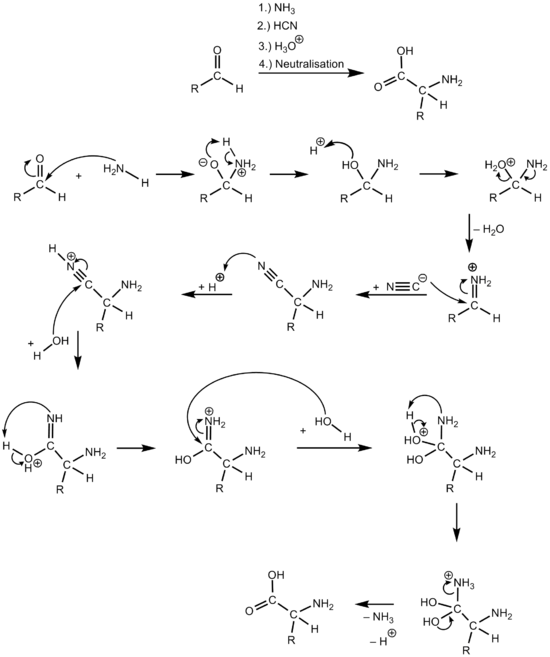
[editar]La reacción transcurre a través de la adición nucleófila de amoniaco al aldehído, por regla general, se obtiene la imina. Estas especies también son electrófilas, por lo que adicionan el cianuro, que produce un α-aminonitrilo, que puede ser hidrolizado en condiciones ácidas a α-aminoácido:
Referencias
[editar]- ↑ a b c L.G. Wade, Jr. (2004). «24». Química Orgánica. Pearson Education S. A.
- ↑ Strecker, A. Ann. Chem. Pharm. 1850, 75, 27.
- ↑ Strecker, A. Ann. Chem. Pharm. 1854, 91, 349.
- ↑ Kendall, E. C.; McKenzie, B. F. Organic Syntheses, Coll. Vol. 1, p.21 (1941); Vol. 9, p.4 (1929). (Artículo)
- ↑ Duthaler, R. O. Tetrahedron, 1994, 50, 1539-1650. (Revisión, doi 10.1016/S0040-4020(01)80840-1)
- ↑ Cativiela, C.; Díaz-de-Villegas, M. D. Tetrahedron: Asymmetry, 2007, 18, 569-623. (Revisión, doi 10.1016/j.tetasy.2007.02.003 )
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
