Azanida
| Anión amida | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Azanida | ||
| General | ||
| Otros nombres | monoamida, ion amida, ion amonio, amida, amonida | |
| Fórmula estructural |
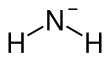 | |
| Fórmula molecular | NH2− | |
| Identificadores | ||
| Número CAS | 17655-31-1[1] | |
| ChEBI | 29337 | |
| ChemSpider | 2104824 | |
| PubChem | 2826723 | |
| Propiedades físicas | ||
| Masa molar | 16,018724 g/mol | |
Azanida es el nombre aprobado por la IUPAC para el anión NH−
2. El término es oscuro; los derivados del NH−
2 se denominan casi siempre amidas,[2][3][4] a pesar de que amida también se refiere al grupo funcional orgánico C(=O)−NR
2. El anión NH−
2 es la base conjugada del amoníaco, por lo que se forma por la autoionización del amoníaco. Se produce por desprotonación del amoníaco, normalmente con bases fuertes o un metal alcalino. La azanida tiene un ángulo de enlace H-N-H de 104,5°.
Derivados de metales alcalinos
[editar]Los derivados de metales alcalinos son los más conocidos, aunque suelen denominarse amidas de metales alcalinos. Algunos ejemplos son la amida de litio, la amida de sodio y la amida de potasio. Estos sólidos similares a sales se producen tratando el amoníaco líquido con bases fuertes o directamente con los metales alcalinos (soluciones de amoníaco líquido azul debido al electrón solvatado):[2][3][5]
2 M + 2 NH
3 → 2 MNH
2 + H
2, donde M = Li, Na, K
La amida de plata(I) (AgNH2) se prepara de forma similar.[4]
Los complejos de metales de transición del ligando amido se producen a menudo por reacción de metátesis salina o por desprotonación de complejos de aminas metálicas.
Referencias
[editar]- ↑ Número CAS
- ↑ a b Bergstrom, F. W. (1940). «Sodium Amide». Organic Syntheses 20: 86. doi:10.15227/orgsyn.020.0086.
- ↑ a b P. W. Schenk (1963). «Lithium amide». En G. Brauer, ed. Handbook of Preparative Inorganic Chemistry, 2nd Ed. 1. New York, NY: Academic Press. p. 454.
- ↑ a b O. Glemser, H. Sauer (1963). «Silver Amide». En G. Brauer, ed. Handbook of Preparative Inorganic Chemistry 1 (2nd edición). New York, NY: Academic Press. p. 1043.
- ↑ Greenlee, K. W.; Henne, A. L. (1946). «Sodium Amide». Inorganic Syntheses. Inorganic Syntheses 2. pp. 128-135. ISBN 9780470132333. doi:10.1002/9780470132333.ch38.
Enlaces externos
[editar]- Esta obra contiene una traducción derivada de «Azanide» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
