Éter de sililo
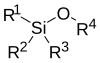
Los éteres de silicio son un grupo de compuestos orgánicos que contienen átomos de silicio unidos covalentemente a un grupo alcoxi. La estructura general es R1R2R3Si−O−R4, donde R4 es un grupo alquilo o un grupo arilo. Los éteres de sililo son usados generalmente como grupos protectores para alcoholes en síntesis orgánica. Dado que R1R2R3 puede ser combinaciones de grupos diferentes que pueden ser variados con el fin de proveer un número de éteres de sililo, este grupo de compuestos químicos provee un amplio espectro para la selectividad de la química de los grupos protectores. Algunos éteres de sililo comunes son los de: trimetilsililo (TMS), tert-butildifenilsililo (TBDPS), tert-butildimetilsilil (TBS/TBDMS) y triisopropilsilil (TIPS), [2-(trimetilsilil)etoxi]metil (SEM). Estos son particularmente útiles debido a que pueden ser instalados y eliminados muy selectivamente bajo condiciones moderadas.
Formación
[editar]Aunque hay muchos métodos disponibles para la formación de éteres de sililo, hay dos estrategias comunes: la reacción del alcohol con un cloruro de sililo con una base amina a temperatura ambiente, y la reacción de un alcohol con un triflato de sililo con una base amina no nucleofílica a temperatura baja. Los triflatos de sililo son más reactivos que sus cloruros correspondientes, así que pueden ser usados para instalar grupos sililo en posiciones más cubiertas. Un procedimiento extremadamente confiable y rápido es el protocolo Corey, en el que el alcohol es hecho reaccionar con un cloruro de sililo e imidazol a alta concentración en DMF.[1] Si la DMF es sustituida por diclorometano, la reacción es algo más lenta, pero la purificación del compuesto se simplifica. Una base impedida estéricamente para su uso con los triflatos de sililo es la 2,6-lutidina.[2] Los alcoholes primarios pueden ser protegidos en menos de una hora, mientras que algunos alcoholes cubiertos pueden requerir días de tiempo de reacción.
Cuando se usa un cloruro de sililo, no se suele requerir tomar precauciones especiales, excepto por la exclusión de grandes cantidades de agua. Un exceso de cloruro de sililo puede ser empleado, pero no es necesario. Si se usa un exceso de reactivo, el producto requerirá separación por cromatografía para eliminar el exceso de silanol y siloxano. Los triflatos de sililo son sensibles al agua, y deben ser manejados bajo condiciones de una atmósfera inerte. La purificación involucra la adición de un ácido acuoso, como una solución saturada de cloruro de amonio. Este atrapa el reactivo de sililo sobrante, y protona las bases amina, eliminándolas de la mezcla reactante. Después de la extracción, el producto puede ser purificado por cromatografía flash.
El triflato de sililo es más reactivo, y también convierte a las cetonas a éteres de sililenol.
Eliminación de los grupos protectores éter de sililo
[editar]La reacción con ácidos o fluoruros, como l fluoruro de tetra-n-butilamonio elimina el grupo sililo cuando ya no se necesita protección. Los sustituyentes más grandes aumentan la resistencia a la hidrólisis, pero también hacen la introducción del grupo sililo más difícil.
En medio ácido, la estabilidad relativa es:
- TMS (1) < TES (64) < TBS (20 000) < TIPS (700 000) < TBDPS (5 000 000)
En medio básico, la estabilidad relativa es:
- TMS (1) < TES (10-100) < TBS~TBDPS (20 000) < TIPS (100 000)
Referencias
[editar]- ↑ Corey, E. J.; Venkateswarlu, A. "Protection of hydroxyl groups as tert-butyldimethylsilyl derivatives." J. Am. Chem. Soc. 1972, 94, 6190–6191. doi 10.1021/ja00772a043
- ↑ Corey, E. J.; Cho, H.; Rücker C.; Hua, D. H. "Studies with trialkylsilyltriflates: new syntheses and applications." Tetrahedron Lett. 1981, 22, 3455–3458. doi 10.1016/S0040-4039(01)81930-4
Enlaces externos
[editar]- Example deprotection TBS silyl ether
- Example deprotection TBDMS silyl ether
- Silicon-based Protection of the Hydroxyl Group
- silyl ether formation in carbohydrates
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
