Trifluoracetophenon
aus Wikipedia, der freien Enzyklopädie
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
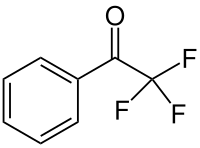
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Trifluoracetophenon | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H5F3O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 174,12 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
1,24 g·cm−3 (25 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Diethylether, Ethanol und Benzol[3] | ||||||||||||||||||
| Brechungsindex |
1,458 (20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Trifluoracetophenon ist eine organisch-chemische Verbindung aus der Gruppe der Ketone, wobei an die Carbonylgruppe eine Phenylgruppe und eine Trifluormethylgruppe gebunden ist.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Trifluoracetophenon kann durch Friedel-Crafts-Acylierung hergestellt werden. Dazu wird Benzol in Kohlenstoffdisulfid mit Aluminiumchlorid und Trifluoracetylchlorid umgesetzt.[3]
Reaktionen und Verwendung
[Bearbeiten | Quelltext bearbeiten]Trifluoracetophenon kann als Quelle für Trifluormethylgruppen zur Herstellung von Trifluormethylkupfer dienen. Dazu wird zunächst in Dimethylformamid ein Komplex aus Kupfer(I)-chlorid und Kalium-tert-butanolat hergestellt und dann das Trifluoracetophenon zugesetzt. Trifluormethylkupfer wiederum dient als Reagenz für Trifluormethylierungen.[4] Nicht-enolisierbare Ketone wie Benzophenon können mit Trifluoracetophenon und Kalium-tert-butanolat direkt trifluormethyliert werden.[5]
Daneben eignet sich Trifluoracetophenon als Katalysator für Oxidationsreaktionen. Als stöchiometrisches Oxidationsmittel dient dabei Wasserstoffperoxid. Trifluoracetophenon liegt überwiegend als Ketonhydrat vor, bei dem in Gegenwart von Wasserstoffperoxid vermutlich eine oder beide Hydroxygruppen gegen Hydroperoxid-Gruppen ausgetauscht werden können, wodurch das eigentliche Oxidationsmittel gebildet wird. Dieses eignet sich, um tertiäre Amine mit über 95 % Ausbeute in N-Oxide zu überführen, beispielsweise Pyridin zu Pyridin-N-oxid oder N-Methylmorpholin zu N-Methylmorpholin-N-oxid.[6] Auch als Katalysator für die Epoxidierung von Alkenen mit Wasserstoffperoxid ist es geeignet.[7]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h Datenblatt 2,2,2-Trifluoracetophenon, 99% bei Sigma-Aldrich, abgerufen am 29. Juni 2024 (PDF).
- ↑ David R. Lide: CRC Handbook of Chemistry and Physics, 85th Edition. Taylor & Francis, 2004, ISBN 978-0-8493-0485-9, S. 3–548 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b J. H. Simons, Edward O. Ramler: Preparation and Properties of Some New Trifluoromethyl Compounds. In: Journal of the American Chemical Society. Band 65, Nr. 3, März 1943, S. 389–392, doi:10.1021/ja01243a024.
- ↑ Hiroki Serizawa, Kohsuke Aikawa, Koichi Mikami: Direct Synthesis of a Trifluoromethyl Copper Reagent from Trifluoromethyl Ketones: Application to Trifluoromethylation. In: Chemistry – A European Journal. Band 19, Nr. 52, 23. Dezember 2013, S. 17692–17697, doi:10.1002/chem.201303828.
- ↑ Lukas Jablonski, Thierry Billard, Bernard R Langlois: Trifluoroacetophenone as nucleophilic trifluoromethylating reagent. In: Tetrahedron Letters. Band 44, Nr. 5, Januar 2003, S. 1055–1057, doi:10.1016/S0040-4039(02)02718-1.
- ↑ Dimitris Limnios, Christoforos G. Kokotos: 2,2,2‐Trifluoroacetophenone as an Organocatalyst for the Oxidation of Tertiary Amines and Azines to N ‐Oxides. In: Chemistry – A European Journal. Band 20, Nr. 2, 7. Januar 2014, S. 559–563, doi:10.1002/chem.201303360.
- ↑ Dimitris Limnios, Christoforos G. Kokotos: 2,2,2-Trifluoroacetophenone: An Organocatalyst for an Environmentally Friendly Epoxidation of Alkenes. In: The Journal of Organic Chemistry. Band 79, Nr. 10, 16. Mai 2014, S. 4270–4276, doi:10.1021/jo5003938.
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.


