Ammoniumiodat
aus Wikipedia, der freien Enzyklopädie
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
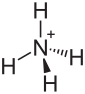 
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Ammoniumiodat | ||||||||||||
| Summenformel | NH4IO3 | ||||||||||||
| Kurzbeschreibung |
farb- und geruchloser Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 192,94 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Dichte |
3,309 g·cm−3[1] | ||||||||||||
| Schmelzpunkt |
Zersetzung ab 150 °C[2] | ||||||||||||
| Löslichkeit |
20,6 g·l−1 bei 20 °C[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Ammoniumiodat ist das Ammoniumsalz der Iodsäure. Es ist ein weißes, in Wasser schwer lösliches Salz, das – wie alle Iodate – oxidierend wirkt.[3]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Ammoniumiodat kann durch die Neutralisation von Iodsäure mit Ammoniak hergestellt werden.[2]
Es kann auch mit einem Ammoniumsalz aus einer Iodatlösung ausgefällt werden.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Ammoniumiodat löst sich schlecht in kaltem, und mäßig in warmem Wasser. Es enthält ein oxidierendes Anion und ein reduzierendes Kation, daher zersetzt es sich schon bei 150 °C zu Stickstoff, Sauerstoff, Iod und Wasser.
Ab 60 °C kann sich die Reaktion ohne äußere Hitzequelle aufrechterhalten. Mit 10 % Kaliumdichromat oder Kupfer(II)-chlorid als Katalysator kann Ammoniumiodat schon bei Raumtemperatur verbrennen, dabei kann man die Entwicklung von lilafarbenen Ioddampf beobachten.[2]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Ammoniumiodat ist ein starkes Oxidationsmittel und kann mit brennbaren Stoffen heftig reagieren.[1]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g Datenblatt Ammonium iodate, 99% bei Alfa Aesar, abgerufen am 11. März 2022 (Seite nicht mehr abrufbar).
- ↑ a b c A. A. Shidlovskiy: COMBUSTION OF THE INORGANIC SALTS AMMONILM IODATE AND HYDROXYLAMINE SULFATE, Zhurnal Prikladnoy Khimii, Vol. 35, No. 3, 1962, S. 511–516.
- ↑ Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 604.
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.





