Калиев хлорат
| Калиев хлорат | |
|---|---|
| |
| Обща информация | |
| Систематично име | Калиев хлорат |
| Други имена | Бертолетова сол |
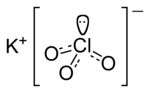
| Молекулна формула | KClO3 |
| SMILES | |
| Моларна маса | 122,55 g/mol |
| Външен вид | кристали |
| CAS номер | [3811-04-9] |
| Свойства | |
| Плътност и фаза | 2,32 g·cm−3, твърда |
| Разтворимост във вода | 7,3 g/100 ml (20 °C) 55,5 g/100 ml (100 °C) |
| Разтворимост | |
| Точка на топене | 356 – 368 °C [1] |
| Точка на кипене | 400 °C (разлагане) |
| Киселинност (pKa) | |
| Вискозитет | |
| Диполен момент | |
| Опасности | |
| Основни опасности | Окислител, поддържа горенето |
| Точка на възпламеняване | |
| Допълнителни данни | |
| Структура и свойства |
n, εr, и др. |
| Термодинамични данни |
Фазово поведение Твърдо състояние, течност, газ |
| Спектрални данни | УВ, ИЧ, ЯМР, МС |
| Сродни съединения | |
| Сродни съединения | калиев нитрат калиев хидроксид калиев хлорид калиев сулфат калиев карбонат (поташ) натриев хлорат |
| Освен където е обявено друго, данните са дадени за материали в стандартно състояние (при 25 °C, 100 kPa) Права и справки | |
Калиевият хлорат е калиева сол на хлорната киселина с химическа формула KClO3. Друго наименование е „бертолетова сол“ по името на Клод Луи Бертоле, който е изследвал съединенията на хлора.
Съединението има неутрален или слабо алкален характер и е силен окислител. При нагряване се разлага най-напред на калиев перхлорат и калиев хлорид:
при по-нататъшно нагряване калиевият перхлорат се разпада на калиев хлорид и кислород. Сумарното уравнение е:
За разлика от напр. калиевия нитрат, калиевият хлорат може да отдаде всичкия кислород, който се съдържа в него. Освен това процесът на разлагане е екзотермичен (ΔH=-10,6 kcal/mol), поради тези причини бертолетовата сол надминава по окислителни свойства доста други съединения и смесите му с горими материали се запалват по-лесно. Като силно реактивоспособно съединение то не се среща в природата, а се получава само по изкуствени методи. Най-често се получава при електролиза на воден разтвор на натриев хлорид[1]. Като междинен продукт се получава натриев хлорат, към който се добавя калиев хлорид, за да се утаи калиевият хлорат. Може да се получи и чрез директна електролиза на разтвор на калиев хлорид.
Неутралните и алкалните водни разтвори на бертолетовата сол не проявяват окислителни свойства. Кисели разтвори обаче действат като силни окислители заради отделянето на хлорна киселина. Съединението е слабо отровно, като леталната доза за възрастен е около 15 до 30 g.
Главно приложение намира при получаването на хлорен диоксид, който от своя страна се използва за избелване. В някои държави се използва като евтин и ефективен хербицид. Калиевият хлорат е малко хигроскопичен и е предпочитан пред други хлорати като окислител в пиротехниката. Само̀ по себе си съединението не е опасно, но смесите му с редуктори като сяра, метали (алуминий, магнезий и др.), въглерод и горими органични материали може да проявят при дадени обстоятелства експлозивен характер. Смесите със сяра могат да се самозапалят, като причина за това често се споменава образуването на малки количества сярна киселина на повърхността на серните частички. По тази причина се препоръчва замяната на калиевия хлорат в пиротехнически смеси с калиев перхлорат[2]. Сместа на бертолетовата сол с фосфор се нарича „смес на Армстронг“ и може да се взриви и при най-леко триене или нагряване. Калиевият хлорат влиза в състава на барута за кибритените клечки. При триене на клечките в „стъргалото“ хлоратът влиза в контакт с фосфора, който се съдържа там, и се запалва.
Може да се използва за получаване на кислород в лабораторни условия, най-често в смес с манганов диоксид MnO2, който снижава температурата на разлагане на хлората. В автомобилната индустрия се прилага във въздушни възглавници. При удар на автомобила капсула, съдържаща калиев хлорат, отделя газове, които издуват възглавницата.
Източници
[редактиране | редактиране на кода]Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.




